Galvanización
1 - Introducción
La galvanización, dicha también galvanizado, es un proceso que permite recubrir las superficies de un material conductor de electricidad con otro material igualmente conductor. Es utilizada principalmente en ámbito industrial, para recubrir objetos metálicos con otro metales mas nobles o preciosos. Se realiza sumergiendo el objeto para recubrir en una disolución especial, que, a través de la acción de la corriente eléctrica, crea una reacción química que deposita sobre el objeto una capa del metal deseado.
1.1 - Los metales de recubrimiento
Los metales mas utilizados para recubrir son oro, plata, cobre, níquel, cromo y zinc. Muchos de estos metales tienen las propriedades de resistir bien a la corrosión y a la usura del tiempo, y son utilizados para proteger el objeto y volverlo mas duradero. Algunos mejoran también las propriedades estéticas, como el cromo, que da un efecto de metal lucido (son un ejemplo los grifos de los baños, que muchas veces son en acero, metal opaco, recubierto de cromo). Otros le dan al metal mas valor, como oro y plata. En general los metales utilizados para el galvanizado son elementos puros, pero a veces pueden ser usados también aleaciones de metales, como el latón.
1.2 - Los objetos para recubrir
No existen limitaciones sobre la forma y las dimensiones de los objetos para recubrir. Como que el proceso de recubrimiento ocurre sumergiendo el objeto en una disolución liquida, es posible recubrir también partes que mediante otras maneras, como por ejemplo la pintura, serian difíciles de alcanzar. La única condición necesaria para efectuar correctamente el proceso es que el objeto pueda conducir la electricidad. Según esta condición, se puede distinguir entre galvanización y galvanoplastia. La galvanización se ocupa del cubrimiento de objetos conductores, mientras la galvanoplastia de objetos no conductores.
1.3 - Los electrodos y el baño galvánico
La disolución liquida en la que ocurre el proceso de galvanizado se llama baño galvánico. Esta disolución es típicamente formada por agua y por la sal del metal que se desea depositar. En algunos casos, como por ejemplo para los metales preciosos, se utilizan también baño galvánicos con cianuro, llamados baños al cianuro. Su utilización es pero complicada, ya que el cianuro es una substancia muy venenosa y las fabricas que la usan deben tener especiales autorizaciones estatales y técnicos especializados.
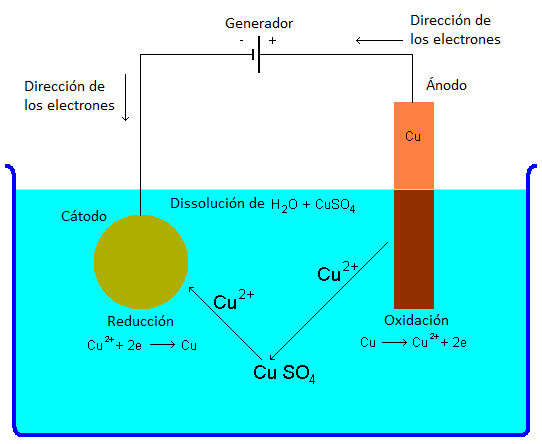
Los electrodos son los elementos de material conductor sumergidos en la solución que permiten a la corriente eléctrica de fluir a través de la disolución para que ocurra la galvanización. El electrodo conectado al polo negativo de la batería se llama cátodo, y coincide con el objeto para recubrir. El electrodo conectado al polo positivo de la batería se llama ánodo, y puede ser hecho del mismo metal que se quiere depositar sobre el objeto para recubrir, o también de otro metal o grafito.
1.4 - La velocidad de deposición
La velocidad de deposición del metal sobre el objeto varia según muchos factores. Los principales son:
- Concentración de la disolución: mas la disolución es concentrada, mas la deposición ocurre rápida. Disolución mas concentrada significa que ha sido disuelto mas soluto (en este caso el sal del metal para depositar, o el compuesto de cianuro) en agua. Existe de todos modos un limite a la concentración de la disolución, mas allá del cual el soluto no se disolverá mas en disolvente, si no se depositará en el fondo del contenedor, o flotará. En ese caso la solución es saturada: el disolvente no es capaz mas de disolver otro soluto.
- Corriente electrica: Mas corriente eléctrica fluye en los electrodos y en las disolución, mas el recubrimiento ocurre rápidamente. Para aumentar la corriente eléctrica que fluye en el circuito se pueden aumentar dos elementos: la superficie de los electrodos o el voltaje que el generador ofrece. Sin embargo existe una corriente máxima que puede fluir en el circuito: superado este valor, la reacción química de galvanización se apaga, porque la corriente muy intensa provoca otras reacciones diferentes, que prevalen.
1.5 - La magnitudes implicadas
La galvanización se puede realizar tanto para pequeños objetos, como ornamentos o joyerías, cuanto para grandes estructuras, como las carrocerías de los coches. Según las dimensiones del objeto para recubrir, las magnitudes implicadas cambian. Los baños galvánicos pueden tener concentraciones muy bajas o muy altas, según las substancias y los materiales utilizados, y las corrientes pueden variar desde los miliamperios para pequeños objetos hasta las décadas de Amperios para grandes baños galvánicos.
2 - El proceso practico
El proceso de recubrimiento de un objeto metálico mediante galvanización puede ser dividido en tres partes: la preparación de la superficie del objeto, el baño galvánico y, en fin, la limpieza final de la superficie secada.
2.1 - La preparación de la superficie: el decapado
La galvanización requiere que las superficies para recubrir sean perfectamente limpias. Las impurezas de hecho no permiten al metal depositarse y adherir correctamente al objeto. Esta operación se llama decapado. Podemos distinguir entre dos fases:
- Limpieza mecánica: es hecha a través de procedimientos mecánicos, como cepillos metálicos. Tiene el objetivo de eliminar las impurezas mayores, como herrumbre u otros residuos de elaboración industriales. Sin embargo, deja la superficie no perfectamente limpia, con sombras u otras impurezas.
- Limpieza química: es efectuada a través de reacciones químicas, principalmente con ácidos y bases fuertes, como ácido sulfúrico, ácido clorhídrico o hydroxido de sodio. Ya que el objecto es sumergido completamente en el liquido limpiador, la limpieza es total y completa.
Las dos fases son consecutivas, pero en algunos casos solo hace falta la limpieza química.
2.2 - El baño galvánico
En el baño galvánico son sumergidos el cátodo, es decir el objeto para recubrir, y el ánodo, osea otro objeto conductor. Los dos electrodos son conectados a un generador de corriente. Cuando es encende el generador, la corriente empieza a fluir a través de los electrodos y la disolución, y el metal empieza a depositarse. Después de un tiempo suficiente, calculado según muchos factores, el generador es apagado, y es extracto de la solución el objeto recubierto de metal.
2.3 - La elaboración final
Después del galvanizado, el objeto tiene que ser limpiado, para eliminar los residuos del baño galvánico, y eventualmente sometido a otros tratamientos, como la pulidura.
3 - El proceso químico
La galvanización puede se realizada con varias soluciones, que permiten de depositar metales diferentes sobre objetos puestos en baños galvánicos. En esta sección será considerado el caso de una disolución de sulfato cúprico, un sal azul intenso que se puede encontrar en las tiendas de jardinería y que es normalmente usado en agricultura para proteger las plantas desde hongos, algas y bacterias. El resultado del galvanizado con ese producto químico es la deposición de una sutil capa de cobre sobre el objeto sumergido en la disolución. Por favor acuérdense que el cobre es una substancia toxica y tiene que ser manejada con cuidado.
3.1 - Premisa: el enlace iónico
El enlace iónico es un tipo de enlace químico que ocurre típicamente entre dos elementos con una diferencia de electronegatividad superior a 1,9, es decir entre elementos usualmente muy lejos entre ellos en la tabla periódica, normalmente un metal y un no metálico. El resultado de un enlace iónico es generalmente un sal, que es de hecho la unión de un metal con un no metálico. En el caso de sales el elemento con electronegatividad menor (el metal) cede al elemento con electronegatividad mayor (el no metálico) uno o mas electrones, que se insertan en los orbitales del nuevo átomo. En ese momento no existen mas dos elemento neutrales, si no dos iones: el átomo que cedió los electrones se vuelve un catión, osea uno ion cargado positivamente, a cambio el átomo que recibió los electrones se vuelve un anión, osea un átomo cargado negativamente (se note que el termino catión y anión se refieren a polaridades opuestas en comparación con cátodo y ánodo). Catión y anión se atraen, debido al signo opuesto de sus cargas, y se quedan juntos, formando la sal. En el caso de este articulo, la sal es el sulfato cúprico, que tiene composición CuSO4. El catión es Cu2+, que cede dos electrones al anión SO2-4.
3.2 - La corriente
Recordamos que la corriente eléctrica en un metal es físicamente hecha por un flujo de electrones que sale del polo negativo de un generador, y entra en polo positivo de este generador. El flujo efectivo de electrones es entonces opuesto a la dirección convencional normalmente utilizada en electrónica, que prevé que la corriente salga del polo positivo del generador.
3.3 - El proceso
La reacción química que causa la galvanización es una reacción de reducción-oxidación, simplemente llamada redox, porque los átomos del cobre pierden y adquieren electrones. Cuando es encendido, el generador intenta ofrecer los electrones al cátodo, conectado con el polo negativo, y recoger electrones desde el ánodo, conectado al polo positivo. En el caso de este articulo, el cobre del ánodo pierde dos electrones, que se dirigen hacia el generador, y se vuelve un catión Cu2+. Esta reacción se llama oxidación. El sulfato de cobre CuSO4 disuelto en la disolución rompe su enlace ionico, dividiéndose en catión Cu2+ y en el anión SO2-4. El anión SO2-4 se liga con el catión Cu2+ que se había formado al ánodo, y se retransforma en sulfato cúprico CuSO4. El catión Cu2+ que era parte del sulfato cúprico disuelto inicialmente en la solución se dirige hacia el cátodo, donde adquiere dos electrones, provistos por el generador, y se vuelve un elemento neutral, depositándose sobre el objeto. Esta reacción se define reducción.
En total, la reacción implica una transferencia de cobre: el cobre del ánodo deja el electrodo y se liga al sulfato cúprico disuelto en la disolución, mientras el cobre del sulfato cúprico deja el compuesto y se deposita sobre el cátodo. Al final de la galvanización, podemos encontrar esta situación:
- El ánodo, hecho de cobre, ha reducido (aun si poco) sus dimensiones, ya que cedió los átomos al sulfato cúprico.
- La concentración del sulfato cúprico en la disolución ha quedado invariada, ya que los átomos del cobre que el compuesto ha cedido al cátodo han sido substituidos por los átomos que ha recibido desde el ánodo.
- El cátodo, que consiste en el objeto para recubrir, ha aumentado (aun si poco) sus dimensiones, porqué ha adquirido en su superficie los átomos del cobre.
- Desde el punto de vista del generador, el balance neto de electrones es cero: recibió dos electrones del ánodo, pero cedió dos al cátodo.
Copyright 2014-2025 electroimc.com